Перспективы изучения митоза
Обновлено: 18.05.2024
4D-модель показывает процессы, происходящие с белками в клетке во время митоза.
Митоз, то есть непрямое деление клетки, — фундаментальный процесс, лежащий в основе органической жизни. Исследователи из Европейской молекулярно-биологической лаборатории (EMBL) разработали интерактивную карту белков, участвующих в делении клетки. Это 4D-модель, позволяющая в динамике увидеть, какая именно группа белков и в каком месте клетки запускает процесс митоза. Работа ученых опубликована в журнале Nature от 10 сентября.
В 2010 году та же группа исследователей обнаружила участки генома человека, вовлеченные в процесс деления клеток. Эти гены кодируют синтез белков, играющих важную роль в митозе. Таких белков сотни, и деление клетки требует скоординированной работы их всех. В частности, комплекс из белка циклина и фермента протеинкиназы стимулирует начало митоза: когда концентрация циклина достигает максимума, это характеризует метафазу. При наступлении анафазы, наоборот, количество циклина в клетке резко уменьшается, потому что его расщепляют ферменты протеасомы. И это только один из примеров.
По словам главы группы исследователей из EMBL, до сих пор ученым удавалось лишь отслеживать работу одиночных белков в живой клетке. Новая же 4D-модель под названием Mitotic Cell Atlas отображает динамику работы отдельных групп протеинов. Ученый может выбрать любую интересующую его комбинацию белков и увидеть, как они функционируют в процессе деления клетки, отслеживая их взаимосвязь.
Mitotic Cell Atlas: модель работы пяти белков во время митоза. Красным цветом показан белок AURKB, зеленым — NUP107, фиолетовым — CENPA, желтым — CEP192 и голубым — TUBB4B / ©EMBL
Исследование проводили на клетках линии HeLa, которые широко применяются при исследованиях рака. При помощи технологии CRISPR/Cas9 ученые сделали 28 интересующих их белков флуоресцентными. Затем через микроскоп они увидели, где именно в клетке находится «меченые» протеины в каждый момент времени. Разрешающая способность микроскопа позволила подсчитать количество белков в определенных местах клетки. Далее полученные данные были интегрированы с компьютерной моделью. Использоваться она может для изучения не только митоза, но и других клеточных процессов, запускаемых белками, включая смерть клетки, миграции клеток или распространение раковых клеток. Наблюдая за интерактомом клетки, ученые смогут идентифицировать критические уязвимости, то есть такие процессы, когда один белок выполняет несколько задач. Подобная многофункциональность повышает вероятность возникновения сбоев, что, в свою очередь, вызывает развитие болезней.
В целом около 600 различных белков вовлечены в процесс деления клетки. Соответственно, ученым нужно собрать набор данных по всем этим белкам, чтобы сделать модель целостной. На это может уйти несколько лет работы.
Перспективы изучения митоза
Проведен анализ влияния недостатка мелатонина на пролиферативную активность и протекание митоза в клетках тонкой кишки крыс. Показано, что при недостатке мелатонина подавляющее большинство клеток тонкой кишки находилось в состоянии митотического деления, среди которых большое количество было представлено патологическими митозами. На гистологических препаратах при недостатке мелатонина преобладала стадия метафазы митоза, которая наблюдалась почти в половине всех фаз и составляла 51,6 % против 40,8 % в контрольной группе. Основной патологией (16,7 %) преимущественно был К-митоз со слипанием хромосом, на втором месте встречалась так называемая патология при расхождении хромосом (9,6 %). Таким образом, опыт показал, что недостаток мелатонина резко увеличивает количество патологических митозов в клетках тонкой кишки крыс, что может указывать на появление злокачественных опухолей. Вместе с тем происходит увеличение пролиферативной активности в тонкой кишке крыс.
1. Анисимов В.Н. Эпифиз и продукция мелатонина // Мелатонин в физиологии и патологии желудочно-кишечного тракта; под ред. акад. РАМН Ф.И. Комарова. – М.: Сов. спорт, 2000b. – С. 6–23.
2. Антонова О.І. Вплив хронічної гіпермелатонінемії на стан печінки щурів / Антонова О.І., Цебржинський О.І. // Вісник Луганського національного педагогічного університету імені Тараса Шевченко. – 2006. – № 13 (18). – С. 6–10.
3. Барабой В.А. Антиокислительная и биологическая активность мелатонина / Барабой В.А. // Укр. біохім. журнал. – 2000. – Т 72, № 3. – С. 5–11.
4. Гуралюк В.М. Стрес-індуковані морфофункціональні зміни надниркових залоз за різної довжини фотоперіоду: автореф. дис. . канд. мед. наук: спец. – Одеса, 2008. – 20 с.
7. Турчина С.И. Сезонные ритмы продукции мелатонина и иммунореактивности у здоровых детей / С.И. Турчина, Н.В. Шляхова // Всероссийская научно-практическая конференция 50 лет мелатонину: итоги и перспективы исследований: тезисы докладов. – СПб., 2008. – С. 41.
8. Anisimov V.N. Melatonin and colon carcinogenesis: Inhibitory effects of melatonin on development of intestinal tumours induced by 1,2-dimethylhydrazine in rats / V.N. Anisimov, I.G. Popovich, M.A. Zabezhinski // Carcinogenesis. – 1997. – Vol. 18. – P. 1549–1453.
9. Bubenik G.A. Localization of melatonin in the digestive tract of the rat: effect of maturation, diurnal variation, melatonin treatment and pinealectomy // Horm. Res. – 1980. – Vol. 12. – P. 313–323.
10. Reiter R.J. Melatonin: Lowering the High Price of Freals // News Physiol. Sci. – 2000. – Vol. 15. – P. 246–250.
Мелатонин – это сомногенный нейромедиатор, гормон-антиоксидант. Известно, что мелатонин является универсальным эндогенным адаптогеном, обладает антиоксидантными, иммуномодулирующими свойствами, а снижение его продукции при нарушении светового режима сопровождается признаками ускоренного старения и увеличением риска развития новообразований [3, 6, 10]. У взрослого человека за сутки синтезируется около 30 мг мелатонина, его концентрация в сыворотке крови ночью в 30 раз больше, чем днем, причем пик активности приходится на 2:00 ночи, его продукция подавляется при рецепции световой информации сетчатой оболочкой глаза [1].
Хотя основным источником мелатонина, циркулирующего в крови, является эпифиз, обнаружен и паракринный синтез мелатонина практически во всех органах и тканях: тимусе, желудочно-кишечном тракте (ЖКТ), гонадах, соединительной ткани [9, 10]. В исследованиях на пинеалэктомированных животных продемонстрировано наличие мелатонина в органах желудочно-кишечного тракта [9]. Эти факты свидетельствуют о синтезе мелатонина органами ЖКТ. Но даже на основании этих исследований можно считать, что мелатонин играет важную роль в физиологии ЖКТ и нарушение его секреции может быть причиной различных патологий органов. Высокий уровень мелатонина в организме подчеркивает его необходимость для жизнедеятельности человека. Мелатонин связывает свободные радикалы кислорода, одновременно запуская естественную систему антиоксидантной защиты супероксиддисмутазы и глутатионпероксидазы. Как антиоксидант мелатонин действует повсеместно, проникая через все биологические барьеры. В исследованиях in vitro было выявлено, что мелатонин обладает значительно большей антиоксидантной активностью в плане прерывания процессов перекисного окисления липидов и инактивации активных свободных радикалов •OH и ROO•, чем известные антиоксиданты [2, 3].
Большое значение уделяется прооксидантно-антиоксидантному балансу органов и организма в целом, системам защиты и повреждения, универсальной адаптации. А работ, касающихся влияния недостатка мелатонина на морфологическую структуру ткани тонкой кишки, практически нет. Поэтому целью нашего исследования было выявление морфологических и митотических особенностей эпителиоцитов тонкой кишки крыс при недостатке мелатонина.
Материалы и методы исследования
Исследования выполнены на половозрелых белых крысах-самцах линии Wistar массой 220–260 г. Животные были разделены на две группы и содержались в стандартных условиях вивария при постоянной температуре и влажности воздуха, свободном доступе к воде и пище. Первая группа – интактная, животные содержались при световом режиме: 12:00 темнота – 12:00 свет, сроком 30 суток. У второй группы была смоделирована гипомелатонинемия (недостаток мелатонина), животные содержались в режиме постоянного освещения (1000–1500 люкс) 30 суток [4].
Сезон исследования – поздняя весна, когда секреция мелатонина средняя между максимумом зимой и минимумом летом [7]. Животных выводили из эксперимента, осуществляя мгновенную декапитацию под кетаминовым наркозом (40,0 мг/кг массы тела).
Материал для исследования получали путем изъятия части тонкой кишки после вскрытия. В дальнейшем кусочки фиксировали в развернутом виде на доске и окунали их в 10 % раствор нейтрального формалина, проводили через батарею спиртов и заливали в парафиновые блоки. Гистологические срезы окрашивали гематоксилином и эозином. Гистологические препараты изучались в световом микроскопе «OLYMPUS BX-50» при различных увеличениях объектива: х10, х20, х40, х100, и окуляр: 10х. Исследование митотического режима и состояние патологических митозов изучали согласно классификации И.А. Казанцевой [5]. Митозы клетки считали не менее чем в 100 полей зрения микроскопа для каждого гистологического препарата, митотический индекс выражали в промилле (‰), то есть количество митозов на 1000 всех клеток. Спектр патологических митозов исследовали в зависимости от фаз нормально идущего митоза и определения ведущей фазы патологического митоза, которую выражали в процентном соотношении (%).
Результаты исследования и их обсуждение
Как показывают результаты морфологического исследования в контрольной группе, стенки тонкой кишки имеют хорошо развитую слизистую, подслизистую и мышечную оболочки. Поверхность слизистой оболочки имеет неровный вид, благодаря хорошо развитой системе складок, ворсинок и крипт. В кишечных криптах преобладают камбиальные и стволовые клетки. Фигуры митоза преобладают в средней части крипт. Среди клеточных элементов преобладают слизистые энтероциты, клетки Панета и столбчатые энтероциты. Последние образуют так называемую щетиночную кайму. Бокаловидные клетки имеют хорошо развитое ядро, которое находится на базальном или апикальном крае клетки в зависимости от секреторного состояния клетки. Собственная оболочка состоит из рыхлой соединительной ткани, в которой встречается небольшое количество фибробластов, макрофагов и других клеток ретикулоэндотелиальной системы. В подслизистой оболочке преобладают так называемые Брунеровские железы, занимают почти все поле зрения микроскопа. Они представляют собой сложные альвеолярно-трубчатые железы, основой которых являются слизистые гландулоциты. Мышечная оболочка выражена достаточно умеренно и состоит из небольшого количества параллельно расположенных гладких мышечных волокон. Кровеносные сосуды, преимущественно венулы, встречаются во всех полях зрения микроскопа, имеют хорошее кровенаполнение. Во всех полях зрения микроскопа встречаются эпителиоциты, которые находятся в разных фазах нормально протекающего митоза. Митотический режим эпителия слизистого отдела тонкой кишки характеризовался достаточно высоким индексом и составлял от 5,5 до 7,8 промилле. Среди раздела фаз митоза в небольшом количестве наблюдалось преобладание метафаз митотического деления. Таким образом, морфологическое исследование в первой группе препаратов выявило умеренную митотическую активность энтероцитов тонкой кишки крыс, представленную всеми фазами митотического деления клеток (рис. 1).
При исследовании наличия отклонений от нормально идущего митоза в данной гистологической группе были обнаружены единичные формы патологии митозов. В небольшом количестве здесь наблюдались патология профазы митоза – мостики и задержка при расхождении хромосом. Кроме того, единичные патологии метафазы – К-митоз со слипанием хромосом. Последнее утверждение может свидетельствовать о физиологических процессах инволюции энтероцитов в тонкой кишке крыс.
Таким образом, в первой интактной группе стенки тонкой кишки имеют хорошо развитую слизистую, подслизистую и мышечную оболочки. Митотический режим эпителия слизистого отдела тонкой кишки характеризовался достаточно высоким индексом и составлял от 5,5 до 7,8 ‰. Среди фаз митоза в небольшом количестве наблюдалось преобладание метафазы.
Несколько иначе представлен клеточное деление в подопытной группе крыс в которых была смоделирована гипомелатонинемия. Так, во всех полях зрения микроскопа встречались клетки, находившиеся в разных фазах митоза, характеризовались большой пролиферативной активностью (табл. 1).

Рис. 1. Состояние тонкой кишки крыс в интактной группе: 1 – полнокровные венулы; 2 – патология митоза – мостики; 3 – эритроциты; 4 – К-митоз со слипанием хромосом. Окраска: гематоксилин – эозин. Увеличение: об. 20х, ок. 15х
Деление клеток. Митоз
Методический инструментарий: учебник Н.И. Сонина, компьютер с мультимедийным проектором, «Биология» 9 класс; электронное учебное издание ДРОФА «Общие закономерности» Б/9 кл. (мультимедийное приложение к учебнику С.Г. Мамонтова, В.Б.Захарова, Н.И. Сонина); настенная таблица «Клетка»; карточки с изображением фаз митоза; магнитная доска, магниты, микроскопы, микропрепараты «Митоз в корешках лука», презентация «Деление клетки. Митоз».
План урока:
Ход урока
«Все клетки образуются из клеток путем деления»
Р. Вирхов
I. Организационный момент.
II. Проверка домашнего задания.
- кроссворд «Эукариотическая клетка» (Приложение 7)
- тестовая проверка знаний. Приложение 1. Ответы: 1- А; 2 – В; 3 – А; 4 – В; 5 – В; 6 – Г; 7 – Г; 8 – В; 9 – Г; 10 – Б (Обратная связь – самопроверка)
- обозначение структур ядра и их состава
III. Актуализация знаний учащихся. Определение темы урока.
Предлагаю учащимся проблемную задачу:
- Известно, что каждый организм в природе рано или поздно погибает – от других организмов, от болезней или просто от старости. Но, тем не менее, численность организмов многих видов не уменьшается, а виды существуют на Земле сотни тысяч и миллионы лет.
- Какое свойство, присущее всему живому, обеспечивает сохранение видов в ряду поколений?
В ходе обсуждения данной задачи подвожу учащихся к выводу о том, что существование и продолжение жизни на Земле обеспечивает уникальное свойство всех живых организмов – способность к размножению (самовоспроизведению), в основе которого лежит деление клеток.
Молекулярная сущность этого процесса выражается в уникальной способности ДНК к самоудвоению молекул.
– Ребята, посмотрите на оформление доски и определите тему сегодняшнего урока. (На доске с помощью магнитов помещены рисунки: строение клетки, ядро клетки, фазы деления клетки). (Деление клетки. Митоз)
– Запишите тему урока в тетради.
Задание. В ходе работы, установите биологическое значение митоза
IV. Изучение нового материала.
Работа с учебником
Цель: выявить отличие понятий жизненный цикл клетки и митотический цикл.
Задание. Выполните задания на карточке – путеводителе №1. «Митотический цикл деления клеток». Приложение 2.
№1. Прочитайте раздел «Жизненный цикл клетки. Митотический цикл клетки» на с. 137 и ответьте на вопросы:
- что называется жизненным циклом клетки?
- что называется митотическим циклом клетки?
- что общего и чем отличаются эти понятия?
Запишите эти определения в тетрадь и постарайтесь их запомнить.
№2. Беседа о митозе и его фазах с одновременной демонстрацией схем, использованием мультимедийной презентации, заполнением обучающимися таблицы (карточка – путеводитель №1. «Митотический цикл деления клеток»)
Наша задача выяснить, что называется митозом и особенности этапов митоза, научиться их определять на рисунках. (Рис.1 Фазы митоза)
№3. Выполнение лабораторной работы «Митотическое деление клетки (на примере корешка лука)» (Приложение 3)
V. Релаксационная физминутка.
VI. Повторение нового материала.
Анемация фрагмента фильма «Митоз. Митотический цикл клетки» проводится с целью повторения информации в другой форме и представления дополнительной возможности для тех, кто не успел заполнить таблицу доделать ее.
После просмотра фильма обучающиеся формулируют вывод.
Точное распределение генетического материала между дочерними клетками обеспечивает эмбриональное развитие, рост, восстановление органов и тканей после повреждения.
VII. Закрепление изученного материала (индивидуальная самостоятельная работа учащихся).
- «Найди пару» (Соотнести характерные особенности процессов с фазами митоза)
- Установите правильную последовательность фаз митоза в клетках кончика корешка лука.
Ответ: а — интерфаза; б — профаза; в — метафаза; г — анафаза; л, е — ранняя и поздняя телофазы
VIII. Вывод. Итог урока.
– Ответьте, чем понятие «митоз» отличается от понятия «митотический цикл»?
– Раскройте биологическое значение митоза.
IX. Запишите домашнее задание.
Повторить текст на с. 137–142, составить задания для игры «Биологическое лото». Составить по три вопроса разной категории сложности по теме «Митоз». Заполнить часть таблицы №1 «Сравнительная характеристика способов деления клеток», графу «Митоз» (Приложение 6.)
| Фазы | Митоз | Мейоз | |
| Первое деление | Второе деление | ||
Биологическое значение митоза

Непрямое деление клеток-эукариотов – содержащих ядро – называют митозом. В этой статье Вы узнаете, в чём заключается биологическое значение митоза, историю исследования данного процесса.
Стадии митоза
Индивидуальное развитие любого живого организма невозможно без процесса деления клеток. Уникальность митоза состоит в том, что во время деления диплоидной соматической клетки образуется две дочерние клетки, которые обладают одинаковой генетической информацией и имеют равное число хромосом. Другими словами сохраняется преемственность между поколениями клеток-эукариотов.
Весь процесс состоит из четырёх стадий:
В некоторых источниках можно найти развёрнутый список фаз митоза. Так, например, профазе предшествует препрофаза, так называемая подготовка к делению. А также между профазой и метафазой рассматривают этап прометафазы. Однако большинство учёных объединяют препрофазу, профазу и прометафазу в одну единую стадию – профазу.
История исследования процесса
Впервые упоминания о процессе деления клеток встречаются в научной литературе в 1870 году. Но эти описания были неполными и касались только лишь изменения поведения ядер внутри клетки.
Первые попытки исследовать данный процесс принадлежат русским учёным Руссову, Чистякову, а также немецкому учёному Шнейдеру.
которые читают вместе с этой
В 1879 году Шлейхер, немецкий учёный, предложил процесс клеточного деления назвать кариокинезом. Впервые понятие «митоз» ввёл немецкий учёный-гистолог В. Флемминг в начале 1880-х годов. Именно этот термин и стал общепринятым для названия процесса, который завершает разделение хромосом между дочерними клетками.

Рис. 2. Вальтер Флемминг
Ключевой ролью митоза является копирование генетического кода и передача его последующим поколениям. Благодаря данному процессу в ядре поддерживается постоянное число хромосом, которое строго одинаково распределяется между дочерними клетками. С помощью митотического деления наращиваются клетки растительных тканей. У животных организмов митоз лежит в основе дробления оплодотворённого яйца и роста тканей.
Помимо этого биологическим смыслом митоза является:
- Развитие и рост живого организма;
Благодаря этому процессу из одноклеточной зиготы развивается и растёт многоклеточный организм. Митоз является основой эмбрионального развития.
Некоторые участки тела в процессе жизнедеятельности требуют постоянного обновления, например, клетки кожи, эпителий кишечника, эритроциты.
С помощью митоза некоторые организмы могут восстанавливаться из одной части тела. Например, морская звезда может восстановиться всего из одного своего луча. У ящерицы может отрасти новый хвост, у человека восстанавливаются участки кожи.
Данный процесс лежит в основе вегетативного размножения растений. У животных с помощью митоза размножается гидра. Новая особь образуется способом почкования, которое невозможно без деления и увеличения числа клеток. Черви, которые тоже являются животными,размножаются фрагментацией, в основе которой тоже лежит митоз.
Что мы узнали?
Процесс непрямого деления клеток-эукариотов, при котором копируется и сохраняется генетическая информация, называется митозом. Данный процесс проходит в 4 этапа: профаза, метафаза, анафаза и телофаза. Впервые учёные описали процесс деления клеток в 70-80-х годах XIX века. Термин «митоз» ввёл немецкий учёный Вальтер Флемминг. Биологическое значение митоза – обеспечить образование дочерних клеток с идентичной генетической информацией. Непрямое деление лежит в основе развития и роста всех живых организмов, восстановления и регенерации частей тела, а также бесполого размножения.
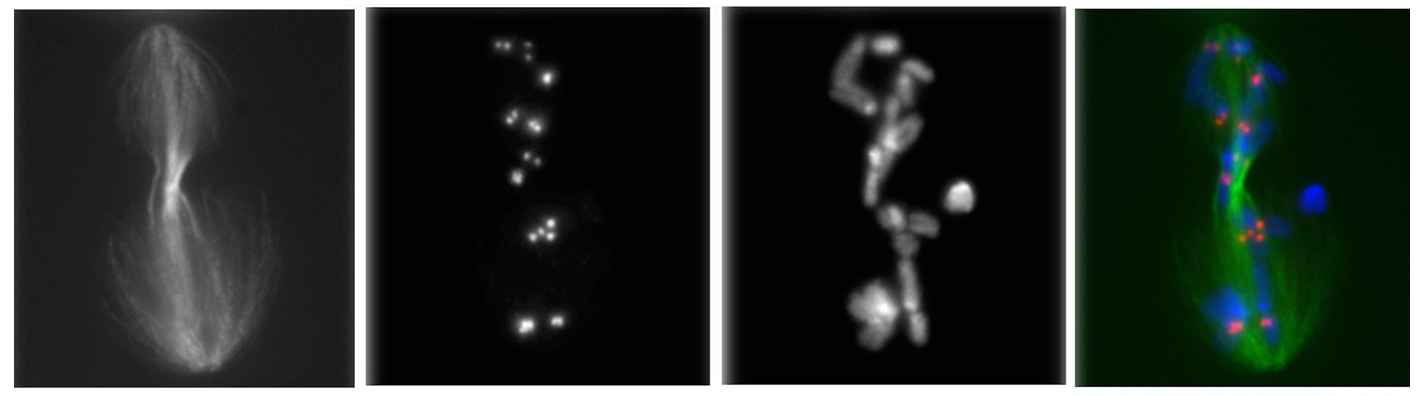
Механизмы кинетохор-зависимого образования микротрубочек у Drosophila

Исследования направлены на изучение митоза, процесса деления соматических клеток эукариот, который обеспечивает точную передачу генетической информации дочерним клеткам. Правильное функционирование всех компонентов этого процесса крайне важно для развития организма. Нарушения митоза приводят к онкологическим заболеваниям и дефектам развития. При митотическом делении клетки после удвоения ДНК начинается процесс расхождения сестринских хроматид к будущим дочерним клеткам.
Расхождение осуществляется специальной высоко динамичной клеточной структурой – веретеном деления, которое соединяет каждый набор хроматид с полюсами делящейся клетки – центросомами. Веретено деления формируется из микротрубочек и в его построении задействованы продукты сотен генов. Мутации этих генов приводят к деформации веретена деления и различным нарушениям расхождения хроматид и последующего деления клетки. На данный момент изучено только небольшое количество генов, контролирующих этапы митоза. Выявление и детальная характеристика всех генов, вовлечённых в этот процесс, является актуальной задачей.
Известно, что микротрубочки веретена деления растут как от центросом, так и от самих хромосом. Рост последних инициируется особыми структурами, формирующимися на хромосомах – кинетохорами. Знания о факторах, существенных для роста микротрубочек от хромосом и кинетохоров, на текущий момент, ограничены и фрагментарны. Один из лучших методов анализа механизмов формирования микротрубочек от кинетохоров заключается в исследовании повторного роста митотических микротрубочек после их разрушения в результате воздействия холодом. Изучение этого процесса, и вовлечённых в него генов, является целью данного исследования. В рамках данного проекта исследования проводятся на модельном организме Drosophila melanogaster. Поскольку большинство белков, необходимых для деления клеток, являются эволюционно высоко-консервативными, полученные результаты прояснят и механизмы формирования веретена деления в клетках человека, что может иметь существенное значение, в частности, для терапии рака.
На первых этапах выполнения проекта был проведен детальный анализ повторного роста микротрубочек веретена деления клеток культуры S2 Drosophila melanogaster после их деполимеризации, вызванной как обработкой клеток колцемидом, так и воздействем низких температур. Полученные данные расширили спектр методических подходов к изучению роста микротрубочек от кинетохоров. Используя как классические, так и вновь разработанные методики, осуществляются исследования влияния РНК-интерференции генов, предположительно участвующих в росте микротрубочек веретена деления от кинетохоров, на формирование веретена деления и сам процесс деления клеток.


Методом РНК-интерференции ведутся серии экспериментов по истощению белков-кандидатов в культивируемых клетках S2 и последующему анализу процесса клеточного деления. На данный момент завершены работы по изучению влияния РНК-интерференции генов Eb1, Klp10A, Klp59C, Klp59D, Klp61F, Klp67A, Asp, Patronin/Ssp4, Mei-38/Ssp1/D-TPX2, Mars/D-HURP, Mast|Orbit, CG7993/Non3, Borr, CG17293, Chc, Clc, Rcd1, Rcd5 и MBD-R2 на митоз. Еще для ряда генов отработаны и апробированы системы РНК-интерференции, в текущий период ведутся эксперименты по их истощению в культуре клеток дрозофилы.
Для изучения прижизненной динамики микротрубочек веретена деления мы получили стабильную линию культуры клеток дрозофилы S2, в которой экспрессируется химерный белок EB1-GFP, маркирующий “+”-концы микротрубочек веретена деления (видео 1). Эта линия используется в экспериментах по холодовой обработке (видео 2) и обработке колцемидом (видео 3) для изучения повторного роста микротрубочек от кинотохоров методом конфокальной микрокопической съёмки.
Методом просвечивающей электронной микроскопии в рамках проекта осуществляется ультраструктурный анализ области кинетохоров на каждой стадии митоза клеток культуры S2 Drosophila melanogaster. Методика фиксации образцов для просвечивающей электронной микроскопии была адаптирована для суспензионной культуры клеток дрозофилы. Этим методом были проанализировали несколько сотен клеток дрозофилы S2, находящихся на разных стадиях митоза. В результате анализа срезов, выполненных под различными углами, было выявлено множество структурных деталей митотического деления и построен детальный портрет процесса митоза на ультраструктурном уровне. Также, методом просвечивающей электронной микросокпии ведётся изучение делящихся клеток S2 со сниженным количеством белков, по нашим данным влияющих на рост микротрубочек от кинетохоров. В таких клетках были обнаружены как дефектные пучки микротрубочек, растущих от кинетохоров, так и изменение формы кинетохоров. Используемый подход позволяет впервые детально описать на ультраструктурном уровне митоз в культивируемых клетках дрозофилы и с таким высоким разрешением изучать нарушения формирования пучков микротрубочек веретена деления, связанных с кинетохорами.



Исследования выполняются под руководством ведущего учёного Маурицио Гатти, который является одним из признанных мировых лидеров в области клеточного деления.
Читайте также:
- Заболевания плечевого и пояснично-крестцового сплетений
- УЗИ печени при аденоме
- Почечная колика. Приступ почечной колики. Причины ( этиология ) почечной колики. Клиника ( признаки ) почечной колики.
- Показания к каротидной ангиографии. Рентгенография позвоночного столба
- Лечение серебром. Российские ученые создали новое лекарство против грибка
