Трансформация клетки. Свойства трансформированной клетки. Признаки трансформированной клетки.
Обновлено: 22.05.2024
Регенерация трансгенного растения из неорганизованной массы делящихся генетически транформированных клеток.
Трансгенным (или генетически модифицированным) называется растение, в геном которого методами генетической инженерии перенесены гены (их называют "трансгенами") из других организмов. Процесс переноса называется генетической трансформацией. Основными преимуществами такой технологии по сравнению с традиционной селекцией являются: возможность переноса всего одного гена, что практически не затрагивает исходный генотип; возможность придания признаков, которые нельзя перенести путем скрещивания с близкородственными видами; значительное ускорение процесса получения новых генотипов.
Наиболее широко используемый метод трансформации - агробактериальный был разработан на основе природного процесса. Почвенная бактерия Agrobacterium tumefaciens способна инфицировать двудольные растения, вызывая опухоли - корончатые галлы. Как выяснилось, при этом происходят перенос и встраивание в растительный геном двух групп генов: продукты одних вмешиваются в нормальный метаболизм растения и способствуют разрастанию опухоли, а продукты других синтезируют опины, вещества, ненужные растению, но используемые в пищу бактериями. Ученые модифицировали агробактерии таким образом, что они вместо собственных переносят в растения гены, нужные человеку.
Впоследствии был разработан ряд других методов трансформации растительных клеток, из которых наибольшее распространение приобрел биобаллистический. Он используется чаще всего для генетической модификации однодольных растений, нечувствительных к агробактериям. В специальных установках микрочастицы золота или вольфрама с нанесенной на них ДНК ускоряют при помощи сжатого гелия, и они проникают в ДНК клеток мишени.
Признаки, которые возможно придать с помощью генной инженерии, весьма разнообразны и в основном ограничены только наличием соответствующих генов. Очень условно их можно разделить на три группы. К первой относятся признаки, интересные производителям: устойчивость к различным факторам окружающей среды - гербицидам, болезням, вредителям, засухе, засолению, улучшение минерального питания, повышение укореняемости. Вторая группа признаков представляет интерес непосредственно для потребителей - модификация вкуса и аромата плодов, увеличение продолжительности их хранения, изменение окраски цветков, бессемянность, улучшение питательной ценности растений. В третью группу входят растения-"биофабрики", способные синтезировать вакцины, ферменты, биополимеры и другие полезные вещества.
ДНК бактерий существуют не только в виде хромосом, но и в виде маленьких кольцевых молекул (плазмид). Бактерии Agrobacterium tumefaciens помимо прочих содержат плазмиды, вызывающие опухоли (Ti-плазмиды). На такой плазмиде среди прочих генов имеется так называемая область Т-ДНК, содержащая гены, отвечающие за образование опухоли на растениях и синтез опинов. Именно этот кусочек плазмиды агробактерии встраивают в ДНК растений. Выяснилось, что агробактерии в принципе способны переносить в растения любую ДНК, которая расположена в этом месте плазмиды. Поэтому в плазмидах, используемых в генно-инженерных целях, природные гены заменяют любыми другими, представляющими интерес для человека. Как правило, это два-три гена: целевой, который придает, например, устойчивость к насекомым; селективный, который придает устойчивость к определенным веществам (чаще всего - антибиотикам), что позволяет трансформированной клетке расти в питательной среде с антибиотиками, в то время как нетрансформированные клетки в ней гибнут; и иногда - репортерный ген, который позволяет качественно определить трансформированную клетку, например, по окрашиванию или свечению в ультрафиолетов ом свете.
В суспензию агробактерий, содержащих плазмиды с нужными генами, добавляют органы или ткани растений (экспланты), из которых проще всего регенерировать целые растения (чаще всего используются листья). Этот этап называется кокультивацией. Во время кокультивации агробактерии с помощью vir-белков переносят участок Ti-плазмиды и встраивают его в растительную ДНК.
Затем растительную ткань помещают на питательную среду, содержащую антибиотики. В этой среде выживают только те клетки, в которые агробактерии перенесли ген, придающий устойчивость к антибиотикам, то есть трансформированные. Условия и состав среды подобраны таким образом, что трансформированные клетки активно размножаются, образуя неорганизованную массу делящихся клеток (калллус), из которой регенерируют трансгенные растения. Полученные растения размножают и подвергают различным анализам сначала в пробирке, а потом - на полях и в теплицах.
Создание одного нового сорта ГМР стоит от 50 до 300 млн долларов и занимает от 6 до 12 лет.
Генетическая трансформация
Генети́ческая трансформа́ция — изменение наследственных свойств клетки в результате внесения в нее генетической информации при помощи чужеродной изолированной дезоксирибонуклеиновой кислоты (ДНК). Трансформация приводит к появлению у трансформированной клетки (трансформанта) и ее потомства новых признаков, характерных для объекта — источника ДНК. Явление трансформации было открыто в 1928 году британским ученым Ф. Гриффитом, который показал возможность превращения непатогенных штаммов вирусов Streptococcus pneumoniae в патогенные штаммы, в результате взаимодействия с убитыми клетками патогенных штаммов. В 1944 году американец О. Эйвери установил, что трансформацию обеспечивают молекулы ДНК, которые являются носителями наследственной информации.
Первоначально трансформация была изучена на примере бактерий пневмококков. Использование в экспериментах легко учитываемых генетических признаков (например, устойчивость к действию клеточных ядов, потребность в определенных факторах роста), а также применение ДНК с радиоизотопной меткой позволили дать трансформации количественную оценку. Трансформацию у бактерий рассматривают как сложный процесс, включающий стадии: фиксация молекул ДНК клеткой-реципиентом; проникновение ДНК внутрь клетки; включение фрагментов трансформирующей ДНК в хромосому клетки-хозяина; формирование «чистых» трансформированных вариантов. Фиксация ДНК происходит на особых участках клеточной поверхности (рецепторах), число которых ограничено. Связанная с рецепторами ДНК сохраняет чувствительность к действию добавленного в среду фермента дезоксирибонуклеазы, вызывающего ее распад. Спустя короткий срок (в пределах одной минуты) после фиксации, часть ДНК проникает в клетку. Бактериальные клетки одного и того же штамма различаются по проницаемости для ДНК. Клетки бактериальной популяции, способные включать чужеродную ДНК, называются компетентными. Число компетентных клеток в популяции незначительно и зависит от генетических особенностей бактерий и фазы роста бактериальной культуры. Развитие компетенции связывают с синтезом особого белка, обеспечивающего проникновение ДНК в клетку.
Поскольку в компетентную клетку может одновременно проникнуть ряд фрагментов трансформирующей ДНК, суммарная величина поглощенной ДНК может быть примерно равна размерам хромосомы клетки-хозяина. После проникновения в клетку двунитевой ДНК одна нить распадается до мононуклеотидов и олигонуклеотидов, вторая — встраивается в хромосому клетки-хозяина путем ее разрывов и воссоединений. Последующая репликация такой гибридной структуры приводит к выщеплению «чистых» клонов трансформантов, в потомстве которых закреплен признак, кодируемый включившейся ДНК.
Применение трансформации позволило провести генетический анализ бактерий, у которых не описано иных форм генетического обмена (конъюгации, трансдукции). Разработка метода трансформации у кишечной палочки позволила использовать для трансформации не только фрагменты бактериальной хромосомы, но и ДНК бактериальных плазмид и бактериофагов. Этот метод используется для внесения в клетку гибридной ДНК в исследованиях по генной инженерии. В 1960-х годах началось изучение трансформации у животных, в конце 1970-х годов — у растений.
Трансформация клетки. Свойства трансформированной клетки. Признаки трансформированной клетки.
Рост и развитие. Деление клеток

А. Особенности деления клеток
Клетки организма обычно находятся под жестким «социальным» контролем: они делятся до образования контактов с соседними клетками, после чего деление останавливается. Такое явление известно как контактное торможение. Исключением составляют эмбриональные клетки, эпителий кишечника (постоянная замена отмирающих клеток), клетки костного мозга (кроветворная система) и опухолевые клетки . Неконтролируемая пролиферация считается важнейшим отличительным признаком опухолевых клеток.
На схеме показано деление клеток в культуре. В то время как нормальные клетки в условиях in vitro делятся до установления контакта с соседними клетками (примерно 20-60 циклов), опухолевые клетки делятся неограниченно долго и не подвержены контактному торможению.
Б. Трансформация клеток
Превращение нормальной клетки в опухолевую носит название трансформация .
В медицине принято различать доброкачественные и злокачественные (малигнизирующие) виды опухолей. Доброкачественные опухоли растут относительно медленно и состоят из дифференцированных клеток. Малигнизирующие опухоли, напротив, демонстрируют способность к быстрому и инвазивному росту и к метастазированию (образованию вторичных опухолей). В соответствии с происхождением опухоли различают примерно 100 различных видов опухолей. В Европе и Северной Америке смертность от онкозаболеваний составляет более 20% от общего числа летальных исходов.
Нормальным клеткам присущи все свойства полностью дифференцированных клеток, выполняющих в организме определенные функции. Они не делятся и обычно находятся в фазе покоя (G 0 -фазе, см. рис. 381). Эти клетки полиморфны и их форма определяется структурированным цитоскелетом.
Напротив, опухолевые клетки часто недифференцированы, по ряду свойств они напоминают эмбриональные клетки и делятся неограниченно; у них изменена клеточная мембрана и они нечувствительны к контактному торможению. Цитоскелет у опухолевых клеток также изменен, часто редуцирован, из-за чего они имеют более или менее округлую форму. Опухолевые клетки могут содержать несколько ядер, не типичных по форме и размерам.
Для клинической идентификации опухолей важно располагать опухолевыми маркерами . Обычно это белки, которые проду цируются опухолевой клеткой (группа 1) или синтезируются другими клетками, взаимо действующими с опухолевыми (группа 2). К опухолевым маркерам группы 1 относятся опухоль-ассоциированные антигены, секре тируемые гормоны и ферменты. В таблице перечислено несколько маркеров этого типа.
Превращение нормальной клетки в трансформированную — процесс многостадийный.
1. Инициация. Почти каждая опухоль на чинается с повреждения ДНК в отдельной клетке. Этот генетический дефект может быть вызван канцерогенами, например канцерогенными веществами (в частности компонентами табачного дыма), физическими факторами (УФ-излучение, рентгеновские лучи, см. рис. 253) или онкогенными вирусами (см. рис. 391). По-видимому, в течение человеческой жизни немалое числи клеток организма из общего их числа 10 14 претерпевает повреждение ДНК. Однако для инициации опухоли важны лишь повреждения протоонкогенов (см. рис. 385). Эти повреждения являются наиболее важным фактором, определяющим трансформацию соматической клетки в опухолевую. К инициации опухоли может привести и повреждение антионкогена (гена-онкосупрессора, см. рис. 385).
2. Промоция опухоли это преимущественное размножение измененных клеток, поврежденных опухоль-инициирующими факторами. Такой процесс может длиться годами. В качестве модельных веществ, инициирующих развитие опухоли, используются форболовые эфиры — вещества растительного происхождения (из растений семейства молочайных), являющиеся активаторами протеинкиназ С (см. рис. 385).
3. Прогрессия опухоли — это процессы размножения малигнизированных клеток, инвазии и метастазирования, ведущие к появлению злокачественной опухоли.
Научная электронная библиотека

Канцерогенез – это многоступенчатый процесс накопления изменений в геноме клеток, приводящий к появлению «асоциальных клеток», характеризующихся морфологическим, функциональным, биохимическим атипизмом, автономным ростом, «ускользанием» клеток от гуморальных и нервных влияний [34].
Касаясь стадий канцерогенеза, необходимо отметить ряд последовательных этапов развития неоплазии, в частности, стадию инициации, стадию размножения опухолевых клеток, или промоции, стадию опухолевой прогрессии [42].
Стадия инициации характеризуется онкогенной трансформацией клеток под влиянием экзогенных или эндогенных факторов. В то же время возможен и эпигеномный механизм воздействия канцерогенов [1, 30, 31, 32].
Как известно, многие химические канцерогены, а также воздействие физических и биологических факторов на организм могут вызывать мутации ДНК, провоцирующие экспрессию протоонкогенов или депрессию (утрату) антионкогенов [54, 108].
При эпигеномном характере действия канцерогенов экспрессия онкогенов возникает в связи с нарушением регуляции клеточного роста без повреждения самого генетического материала [71]. При эпигенетическом коканцерогенном эффекте патогенных факторов возникает инактивация белков – продуктов антионкогенов- или активация пострецепторных ростовых факторов. Такое воздействие, как правило, не вызывает развития опухоли, но усиливает ростовые эффекты других факторов, способствуя пролиферации мутантных клеток и формированию неоплазии.
Эффект канцерогенов-мутагенов называется инициирующим, а коканцерогенов – активирующим.
Прямой генотоксический эффект канцерогенов возникает в процессе алкилирования, делеции, транслокации, амплификации генов. Если мутация затрагивает гены, регулирующие клеточное размножение, клетка становится инициированной, то есть потенциально способной к неограниченному делению, но требующей для фенотипического проявления этого свойства дополнительных воздействий.
Существует множество химических соединений, так называемых промоторов, хроническое воздействие которых на инициированные клетки приводит к развитию второй стадии канцерогенеза – промоции, то есть интенсивному размножению малигнизированных клеток и формированию опухоли.
В механизмах развития промоции важная роль отводится нарушениям взаимодействия онкогенов и антионкогенов, что приводит к синтезу онкобелков в увеличенном количестве или качественно измененном составе. Активация протоонкогенов может происходить в результате точковых мутаций в самом протоонкогене, транслокации протоонкогена или его амплификации [20, 23].
В патогенезе неоплазии, в частности, стадии промоции, важная роль отводится ограничению синтеза белков-супрессоров пролиферации, в связи с подавлением активности генов р53, pRb, индукторов апоптоза, ДНК-репарирующих ферментов, а также гиперэкспрессии Myc, Ras.
Заключительной фазой канцерогенеза является стадия опухолевой прогрессии. Понятие об опухолевой прогрессии введено L.Foulds (1948). Последняя характеризуется не только количественным увеличением опухолевых клеток, но и необратимыми качественными изменениями свойств неопластических клеток.
В процессе опухолевой прогрессии происходит смена доминирующего вначале субклона онкогенно-трансформированных клеток на генетически устойчивые клоны к гуморальному, нервному влиянию, иммунным и лекарственным воздействиям.
Автономия злокачественных клеток обеспечивается за счет нескольких процессов:
1) секреции малигнизированной клеткой митогенов, вызывающих аутокринную стимуляцию пролиферации клеток, в частности, ?-фактора роста опухоли, тромбоцитарного фактора и ?-фактора роста опухоли;
2) количественных и качественных изменений рецепторов к факторам роста, что приводит к снижению или повышению чувствительности опухолевых клеток к действию физиологических регуляторов роста клеток;
3) нарушения передачи сигнала к клеточному росту на пострецепторном уровне;
4) экспрессии онкогенами транскрипционных факторов.
«Ускользание» опухоли от иммунного ответа обеспечивается за счет индукции синтеза блокирующих антител, выделения иммуносупрессорных цитокинов.
Многостадийность канцерогенеза предполагает возникновение последовательных мутаций в значительном количестве доминантных или рецессивных онкогенов или развитие коканцерогенного (синканцерогенного) эффекта под влиянием различных инициирующих факторов – канцерогенов физической, химической, биологической природы.
Общая характеристика атипизма опухолевых клеток
В процессе многостадийного канцерогенеза опухолевые клетки приобретают признаки морфологического, функционального и метаболического атипизма. Последний обстоятельно описан в ряде работ [17].
Тканевой атипизм опухолевых клеток проявляется в снижении их адгезивных способностей вследствие необратимого фосфорилирования белков цитоскелета; при этом нарушается фиксация клеток к межклеточному веществу. Неопластические эпителиальные клетки не образуют базальных мембран и не прикрепляются к ним, утрачивая покровную функцию. Отсоединение от тканевого матрикса опухолевых клеток не вызывает их апоптоза, в отличие от нормальных клеток. Злокачественные клетки выделяют массу цитокинов, вызывающих их аномальную васкуляризацию. В то же время малигнизированные клетки лишены и адекватной иннервации [24].
Атипизм в культуре тканей проявляется отсутствием контактного торможения роста, ослаблением адгезивности, способностью размножаться в полужидкой среде [33, 82, 104, 114].
К морфологическим особенностям опухолевых клеток необходимо отнести нарушение структуры и функции цитоплазматических, митохондриальных, лизосомальных мембран, формирование более высокого дзета-потенциала клеток, уменьшение количества мембранных рецепторов и изменения их структуры, появление новых рецепторов, в связи с чем возникает ослабление, усиление или извращение нервных и гуморальных влияний на трансформированные клетки [9, 10, 73, 78, 93, 111, 112].
Характерными признаками клеточного атипизма являются геномные и хромосомные мутации в виде полиплоидии, ануэплоидии, делеции, дупликации, транслокации, инверсии. Генные мутации при канцерогенезе столь же стереотипны и могут носить характер мягких и жестких мутаций.
Общеизвестными признаками клеточного атипизма являются возрастание ядерно-цитоплазматического соотношения, аномалии форм и размеров клеток в целом, увеличение количества свободных, не связанных с эндоплазматическим ретикулумом рибосом, изменение структур митохондрий и лизосом [109, 110].
Биохимический атипизм раковых клеток проявляется снижением антиоксидантного потенциала, наличием в митохондриях аномальной кольцевой или одноцепочечной ДНК [8].
Одним из проявлений биохимического атипизма является обратный эффект Пастера, характеризующийся преобладанием анаэробного гликолиза над аэробным в условиях оптимальной доставки к малигнизированным клеткам кислорода и глюкозы. Для опухолевых клеток характерна чрезмерная активация пентозного цикла окисления глюкозы – основного поставщика рибозо-5-фосфата, необходимого для синтеза нуклеиновых кислот. Опухолевые клетки интенсивно поглощают из кровотока глюкозу, жирные кислоты, холестерин, липопротеиды, используя их в процессе внутриклеточных метаболических реакций и тем самым вызывая развитие «раковой» кахексии у ряда больных.
Опухолевые клетки потенциально бессмертны (феномен иммортализации) в связи с высокой активностью теломеразы – фермента, восстанавливающего исходную длину теломер после удвоения ДНК, а также в связи с подавлением апоптоза малигнизированных клеток.
Молекулярно-клеточные механизмы биологических особенностей опухолевых клеток и формирование их атипизма будут представлены далее.
Трансформация генов или семь способов создать химеру

Продолжаем знакомить вас с тонкостями работы биотехнологов. Готовы поспорить, что каждый из чтецов этого текста слышал о генно-модифицированных организмах, сокращенно ГМО. Кто-то их боится, кто-то считает их спасением от глобальных проблем человечества, кому-то абсолютно все равно.
Однако мы готовы поспорить, что большая часть читателей даже не представляет, как на практике создают этих самых ГМО или, как их правильнее называть в среде ученых, трансгенных организмов и генетических химер.
Химера или химерный организм — организм, несущий в себе генетический материал, принадлежащий двум и более видам живых существ. Химерой может быть как многоклеточный организм, так и одноклеточный. Кроме того, различают химер по тому, насколько и в каком качестве присутствует чужеродный геном: заимствована ли часть генов, встроены ли они в хромосому реципиента, или же оба генома сохранены полностью, но располагаются в разных клетках. Впрочем, это тема для отдельного поста.
Итак, чтобы создать генетически модифицированный организм, надо изменить его геном. В научной среде изменение генома называется трансформацией.
Трансформация генов – это изменение генетического состава клеток путем привнесения извне чужеродного генетического материала, перенос чужеродных (природных или искусственно созданных) донорских генов в клетки-реципиенты растений, животных и микроорганизмов, и получение таким образом трансгенных организмов с новыми или усиленными свойствами и признаками.
Секундное отступление. Трансформация — не изобретение человека. Бактерии умели передавать друг другу ДНК, захватывать чужую и встраивать ее в свой геном еще задолго даже до появления вирусов. Более того, эти свойства не утрачены даже у более развитых организмов. И, что еще более интересно, природная трансформация, также известная как горизонтальный перенос генов, играет огромную роль в эволюционных механизмах. Но это весьма обширная тема.
Стоит отметить, что трансформация имеет свои особенности для растений и животных. Растительные клетки из-за плотной клеточной стенки поверх мембраны неспособны самостоятельно поглощать фрагменты чужеродной ДНК и воспроизводить их, тогда как клетки животных могут различными способами поглощать фрагменты ДНК, встраивая их в свой геном, или поддерживать их воспроизведение в цитоплазме.
Исходя из этого учеными было разработано два основных метода генетической трансформации растений и еще пять – для животных. Разумеется, на самом деле их гораздо больше, однако по большей части это модификации основных семи. Рассмотрим вкратце каждый из них.
Векторный
По сути является лабораторной адаптацией механизма, называемого трансдукцией — обмен генами у бактерий и некоторых простейших. Пожалуй, он так же заслуживает отдельной статьи, но постараемся кратко.
Вектор — трансформирующий фактор, основой которого является самостоятельный фрагмент ДНК, несущий все необходимое для синтеза РНК и белка. Обычно на основе ДНК или РНК вируса, плазмиды или космиды (свободные генетические элементы бактерий и простейших).
В промышленной и сельскохозяйственной биотехнологии обычно создают векторы с помощью Ti-плазмид бактерий, так как они небольшие по объему, и относительно устойчивые.
Как их создают? Из плазмид выделяют участки Т-ДНК (транспортной), ответственные за встраивание в молекулу ДНК клетки-мишени и создают векторные ДНК (векторы), способные переносить и встраивать нужные последовательности, включая части, кодирующие нужный признак и вещество, а также маркеры (репортерные гены — они нужны для проверки — встроился ли вектор в ДНК реципиента).

Модифицированные агробактерии (или освобожденные плазмиды) помещают в одну среду с растительными клетками-реципиентами, откуда с помощью антибиотиков удаляют нетрансформированные клетки.
К векторной трансформации также относят перенос ДНК с помощью ретровирусов. Векторный перенос можно осуществить только при отсутствии клеточной стенки (т.е. необходимо привести клетку-донор в состояние протопласта).
Трансформированные клетки помещают в питательную среду для культивации (образование каллуса), впоследствии регенерируя из них целое растение.
- Плюсы: адресность (можно сделать так, чтобы вектор встраивался только в определенные участки), возможность проконтролировать встраивание вектора и его сохранность в следующих поколениях клеток.
- Минусы: большая подготовительная работа по синтезу и созданию вектора и его размножению, опасность случайных встраиваний.
Биобаллистический (Генный пистолет)
Биобаллистический или метод «генного пистолета» – применяют в основном в отношении однодольных растений, нечувствительных к агробактериям.
Пожалуй, это самый фантастический способ трансформации. И самый страшный для людей, которые всерьез боятся стать жертвами генной модификации. Ведь его принцип действия полностью соответствует его названию. Да, именно так — это пистолет, стреляющий… генами.

В специальных установках микрочастицы золота или вольфрама с нанесенной на них ДНК ускоряют при помощи сжатого гелия, и они проникают в ДНК клеток-мишеней. Как вариант этого метода встречается магнетофекция – перенос с помощью намагниченных металлических частиц.
- Плюсы: мобильность (можно таскать с собой в поле) и массовость (обработка большого количества клеток разом или целого растения).
- Минусы: внесенная ДНК практически ничем не защищена и может быстро потерять активность, нельзя проконтролировать встраивание.
Векторный и биобаллистический методы универсальны и для растений, и для бактерий, и для животных. Теперь же переходим к методам, характерным для трансформации животных клеток. В принципе, их так же можно применить на растительных клетках, однако придется лишить их клеточной стенки, и знатно повозиться с подготовкой клетки.
Метод микроинъекций
Это самый простой способ внести ДНК в клетку. Вы часто видели его в научно-фантастических фильмах на тему утечки какого-нибудь патогена из секретной лаборатории.
Суть ее заключается во введении целевых генов непосредственно в ядро животной клетки при помощи микрокапиллярной пипетки. Под микроскопом в ядро клетки вводится 1 × 10^(−10)—1 × 10^(−12) л раствора трансформирующей ДНК (несколько тысяч копий генов).

- Плюс: главный плюс этого метода в том, что введенный ген сохраняется внутри клетки, а клеточные структуры почти не повреждаются.
- Минус: при делении клетки только одна из дочерних клеток наследует дополнительную ДНК
Электропорация
Впервые была разработана в лаборатории Е. Неймана в 1982 т. для введения чужеродных нуклеиновых кислот в эукариотические клетки.
В многочисленных опытах было показано, что обработка клеток животных электрическими импульсами с напряженностью поля 5-10 кВ/см в течение 5-10 мкс приводит к поглощению клетками молекул ДНК, находящихся в среде.

- Плюсы: простота использования (кладем клетки в ванну с электролитом, капаем ДНКу, врубаем ток, профит!).
- Минусы: плохая контролируемость встраивания, повреждения ДНК и клеточных мембран.
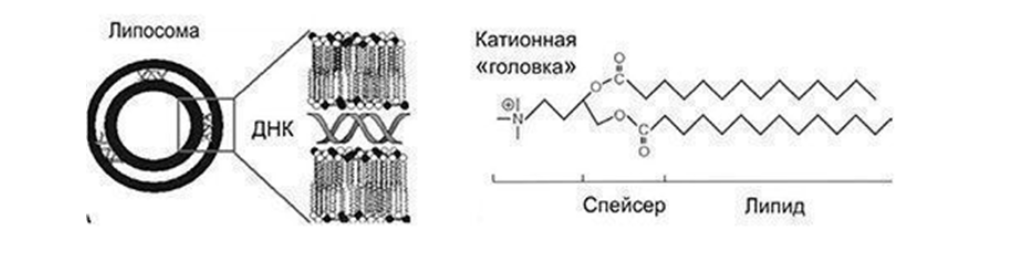
Липофекция
С чем-то подобным сталкиваются блюстители красоты, пользующиеся лосьонами с мицеллами и принимающие жирорастворимые витамины.
Липосомы (мицеллы, везикулы) — “пузырьки” из одного или двух слоев липидов, по свойствам схожих с естественной клеточной мембраной. В основном различают так: липосомы — двухслойные, содержат комплекс гликолипидов, мицеллы — однослойные, преимущественно липидные. Но это не точно:)
Липосомный (везикулярный) метод – пиноцитозное (захват раствора) поглощение метафазных хромосом, заключённых в синтетическую фосфолипидную оболочку (линохромосом или липоплекса). Изолированные метафазные хромосомы способны проникать в чужеродную клетку и функционировать в ней в течение некоторого времени.

Большая часть поглощенных хромосом деградирует, распадаясь на отдельные фрагменты, осуществляющие перенос содержащихся в них генов. Фрагменты могут существовать в свободном состоянии. Гены трансгенома функционируют наряду с другими своими хромосомными генами клетки. Такие популяции клеток называют нестабильными.
При постоянном действии генов трансгенома появляются стабильные популяции клеток (клоны) – когда сохранившийся фрагмент интегрируется с хромосомой клетки реципиента. Интеграция происходит не путем рекомбинаций через двойной кроссинговер, а через транслоцирование фрагментов на негомологичные участки генома реципиента.
Соматическая гибридизация
Слияние соматических клеток с объединением их геномов — образование гибридома. Производится электрическим, химическим и механическим путем. Частный случай гибридизации – использование микрокеток, иногда объединяют с липофекцией.

Введение с помощью микроклеток – клетки доноров обрабатываются таким образом, что часть хромосом или отдельные хромосомы оказываются заключенными в часть цитоплазмы. Слияние микроклетки донора с полноценной клеткой реципиента ведет к тому, что реципиент получает группу или отдельные хромосомы донора.
Это один из самых трудоемких методов создания трансформированных клеток. Однако он полностью оправдывает себя — так, например, производят антитела для лечения редких заболеваний, иммуноглобулины и создают из клеток больных раком пациентов индивидуальные лекарства.
Химическая преципитация
Метод несколько схож с генным пистолетом с той лишь разницей, что частицы ДНК не выстреливаются, а доставляются на соли.
Например, преципитация фосфатом кальция выглядит следующим образом. ДНК добавляют к смеси раствора СаСl2 и фосфатного буфера, ДНК адсорбируется на кристаллах фосфата кальция (Грэхем Ван дер Эб, 1973). Образуются частицы кальциевого преципитата. Они поглощаются клеткой путем фагоцитоза.
Основные методы трансформации закончились. Познакомимся с редкими, но все же встречающимися — некоторые из них весьма любопытны.
Органическая преципитация. Катионные полимеры
По сути, гибрид химической преципитации и фагоцитоза. В основном используют ДЕАЕ-декстран. Преципитация диэтиламиноэтил-декстраном (ДЕАЕ-декстраном) – использование положительно заряженных (катионных) водорастворимых полимеров, таких как ДЭАЭ-декстран, полиэтиленимин, поли-L-лизин или хитозан. Отрицательно заряженная ДНК связывает поликатионы, и образовавшийся положительно заряженный комплекс (полиплекс) взаимодействует с отрицательно заряженной мембраной клетки, что приводит к проникновению ДНК в клетку-мишень путем эндоцитоза. Метод считается малоэффективным из-за сложности с синтезом комплекса и слабом контроле доставки ДНК в ядро.

Фототрансфекция
Перенос фрагментов ДНК через поры, образованные в результате сверхкороткого облучения лазером. По сути, та же электропорация, только вместо тока — свет определенной длины волны.
Трансдукция
Вариация векторного метода для животных клеток. Имеет ряд отличий, например, в качестве вектора применяется фрагмент вирусной ДНК (ретровирусы, ДНК-вирусы, ВИЧ), чаще всего заключенный в реконструированную вирусную оболочку для облегчения проникновения в клетку и обеспечения тканеспецифичности.
Есть и еще менее популярные методы, как, например, трансформация тепловым шоком. Однако она сама по себе не привносит ДНК извне, лишь изменяя структуру существующей ДНК за счет температурных повреждений. Либо тепловой шок может служить тем же фактором повреждения мембраны, что и электрошок, открывая путь для проникновения ДНК. Но в таком случае, по сути он ничем не отличается от вышеназванных.
Итак, мы рассмотрели основные методы создания химерной (трансформированной) клетки или популяции клеток. Несмотря на то, что их характеристика по большей части уместилась в паре строк, каждый из них сопряжен с колоссальными усилиями как при подготовке, так и при исполнении, и тем более при контроле результата. Последнее особенно важно, так как любая клетка имеет свои механизмы защиты.
Мало трансформировать геном, надо еще обеспечить его сохранность и устойчивость — в противном случае, клетка быстро избавится от чужеродного фрагмента, вырезав его или растворив в лизосоме.
Для чего это делают?
На самом деле, трансформированные организмы давно уже нас окружают и служат нам. Стоит только подумать над тем, что первые научные работы на эту тему (на тему трансформации у бактерий) датированы до 1962 года, т.е. до подтверждения структуры ДНК! А сами бактериальные химеры стали применять аж в 1980-х.
Выше мы уже упоминали, что с помощью гибридов изготовляют лекарства от рака и редких заболеваний. Также с помощью трансформированных клеток производят гормоны (человеческий инсулин, ген которого перенесли в кишечную палочку), иммуноглобулины, белки, витамины (витамин С с помощью той же кишечной палочки, фитогормоны для растений с помощью сенной палочки), ферменты для пищевой, текстильной, химической промышленности, биоудобрения и биопрепараты для борьбы с паразитами и вредителями, антибиотики и даже очищают сахар (хотя это совсем уж редкий случай).

Биотехнология: учебник и практикум для вузов / под редакцией Н. В. Загоскиной, Л. В. Назаренко. — 3-е изд., испр. и доп. — Москва: Издательство Юрайт, 2020. — 381 с.
Биотехнология / Т. Г. Волова. – Новосибирск: Изд-во Сибирского отделения Российской Академии наук, 1999. – 252 с
Биотехнология. Принципы и применение / Под ред. И.Хиггенса.- М.: Мир, 1980
Чечина, О. Н. Общая биотехнология: учебное пособие для вузов / О. Н. Чечина. — 2-е изд., перераб. и доп. — Москва: Издательство Юрайт, 2019. — 231 с.
Clough SJ, Bent AF. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 1998 Dec;16(6):735-43.
Godfrey J, Leukam MJ, Smith SM. An update in treating transformed lymphoma. Best Pract Res Clin Haematol. 2018 Sep;31(3):251-261.
Alton, E. W. F. W., Armstrong, D. K., Ashby, D., Bayfield, K. J., Bilton, Diana, Bloomfield, E. V.,… Wolstenholme-Hogg, P. (2015). Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: A randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respiratory Medicine, 3(9), 684-691.
Читайте также:
